EMA将甘精胰岛素这类小分子制品也归属为生物制品★◆◆★★,EMA批准的生物类似物中多款均为小分子制品★★■。但在FDA这类小分子与化学药一样采用NDA的申报途径,而不是生物制品的BLA申报途径★■★★。且在FDA甘精胰岛素审评由CDER负责,而生物制品的审评由CBER负责★◆◆■◆,这也导致FDA的生物类似物获批清单中未将甘精胰岛素这类小分子纳入;
· 在中间产品/中控中控制岩藻糖基化,使得后续生产批次岩藻糖基化水平不超过分析相似性的水平;
d■◆★★★■.某些属性或方法由于本身的特性被排除于数据统计◆★,如定性检测及限度检测可能被层级1或2评估所排除,如氨基酸组成■★★■◆◆,该属性并非不重要,但其无法按照tier 1/2的标准进行数据统计,因此作为tier3属性;
携手筑梦检测新未来——莱伯泰科受邀出席“2024年安徽省检验检测学会学术年会◆◆◆★■★”
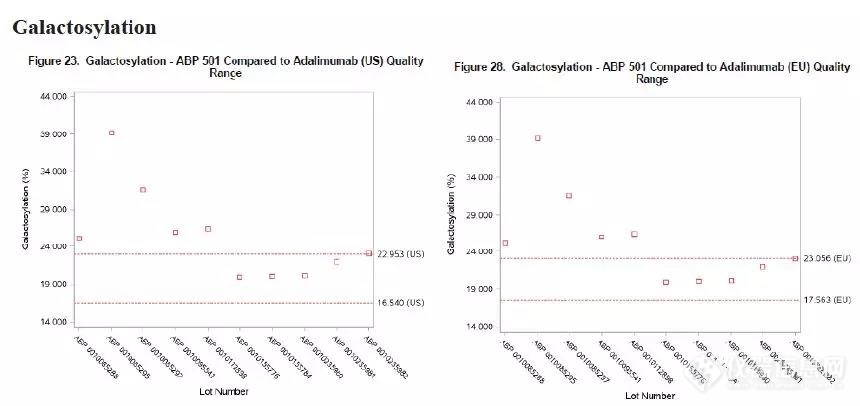
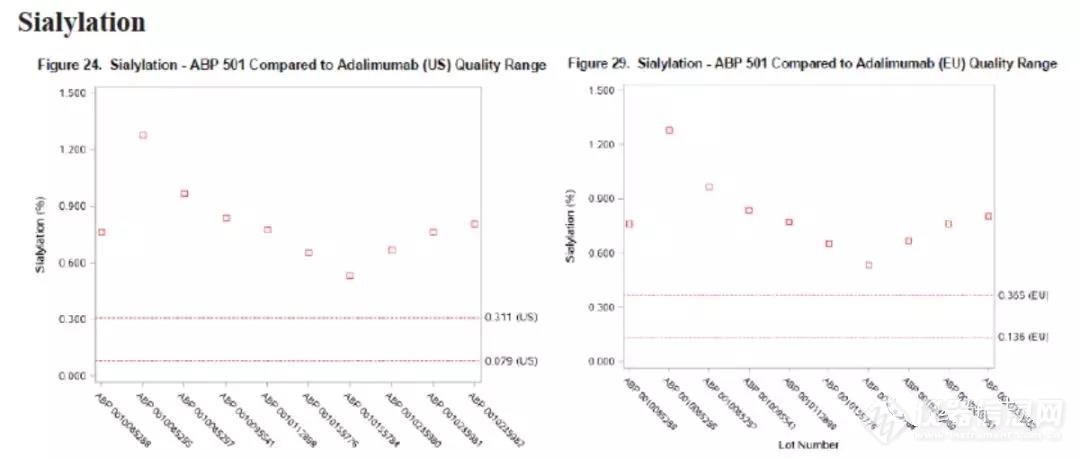
数据显示自研与参比的糖基化类型相同,但各糖型的比例稍有不同。其中非岩澡糖■■■■◆、高甘露糖、半乳糖、唾液酸均与参比不同。半乳糖及唾液酸如下图所示★◆■■:
而据报道非岩藻糖(afucosylated forms)可通过影响产品与FcγRIIIa的结合而最终影响ADCC活性■■★,高甘露糖可影响PK及ADCC活性◆◆★★,唾液酸可影响PK,半乳糖可影响CDC活性。生产商将糖基化作为tier2属性★★◆★■◆,针对糖基化的差异,生产商进行了如下论述,并获得了FDA的认可:
FDA发布的指南都较为宽泛★★■◆◆。而EMA针对生物类似物发布的指南既有较为宽泛的指导性文件★★,也有针对某款产品特异性的指南◆■★◆■,同时EMA的部分指南同时适用于变更及类似物可比性研究,这一点也与FDA完全不同■◆。
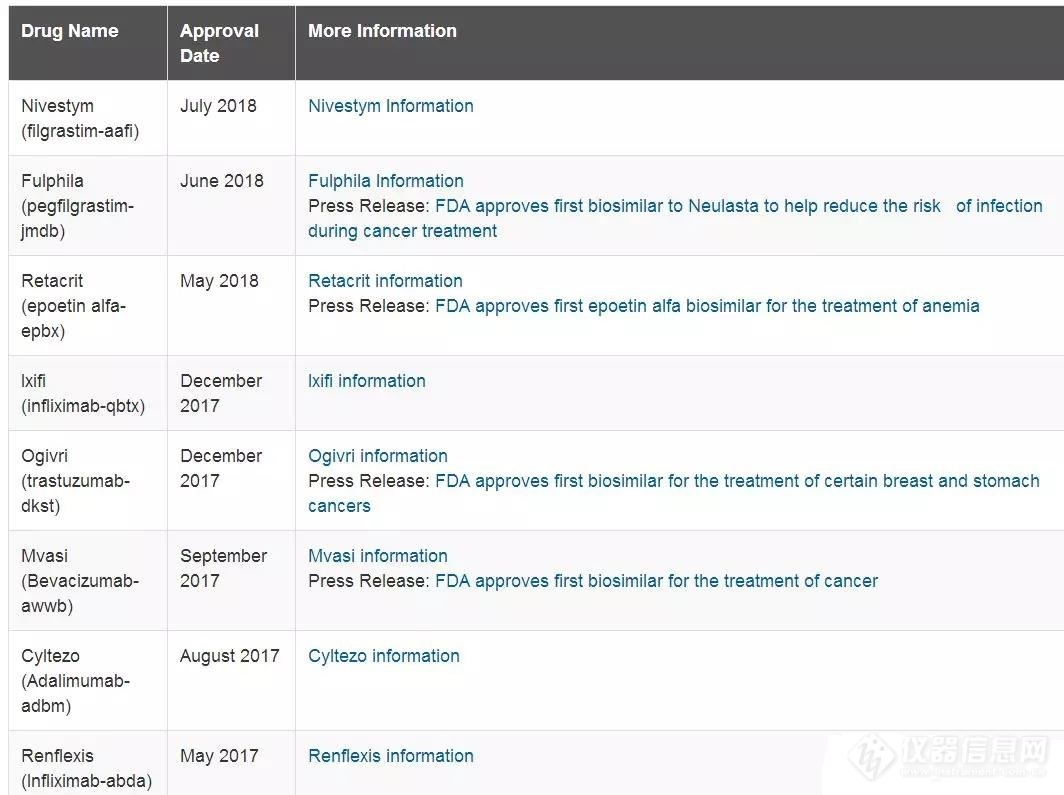
从EMA数据库可以查到,截止2018.8★◆★■◆.24欧盟共有45款生物类似物获批:
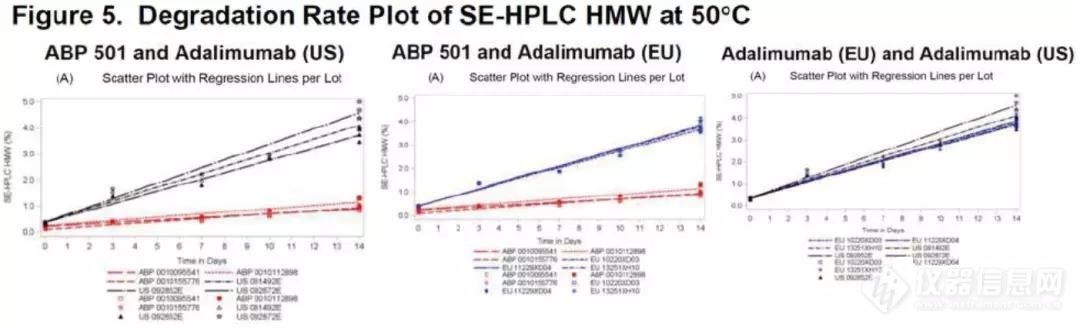
由于Amgen的产品与参比的处方不同(具体处方可见审评报告),因此与预期的一样两者在高温及强降解下降解率不同。而Amgen还将原液配置成与参比一致的处方体系中★■★■★,与参比进行了对比,结果显示不一致是由于处方体系造成的,而非分子本身造成的。
行业对该指南也是有较大的担忧■■,指南要求至少十批参比及自研进行分析相似性研究。而事实上,参比的可获得性一直是困扰生物类似物开发商的一大难题■◆,一段时间内在市场上流通的参比较少,要购买10批次参比进行研究将花费较长时间。
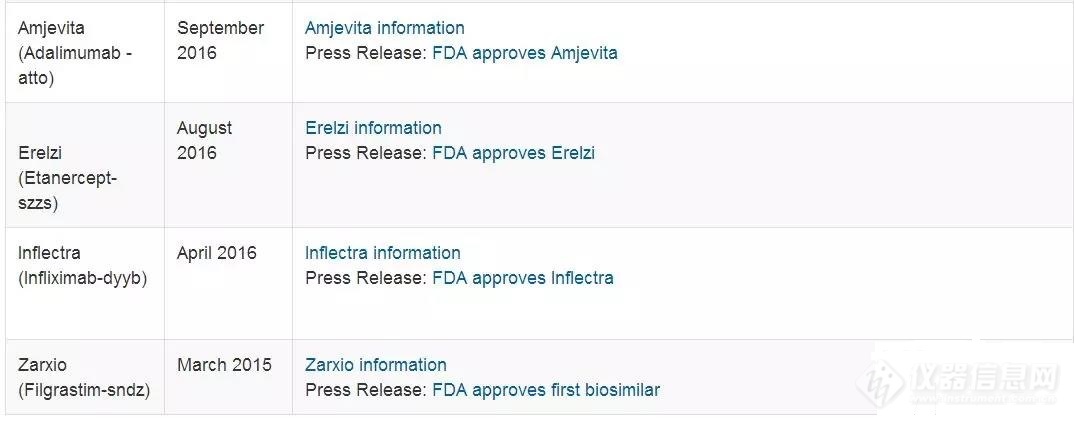
从数据中可以看出FDA批准的生物类似物集中于近几年,2015年1款,2016年3款,2017年5款,2018截至目前为3款■★。有这些基础之后,相信未来FDA批准生物类似物的速度会越来越快◆■★■★。
c■★★★■■.同一质量属性有多个方法进行检测评估时,性能最好的方法应放在风险最高的层级,其他方法则放在风险较低的层级;
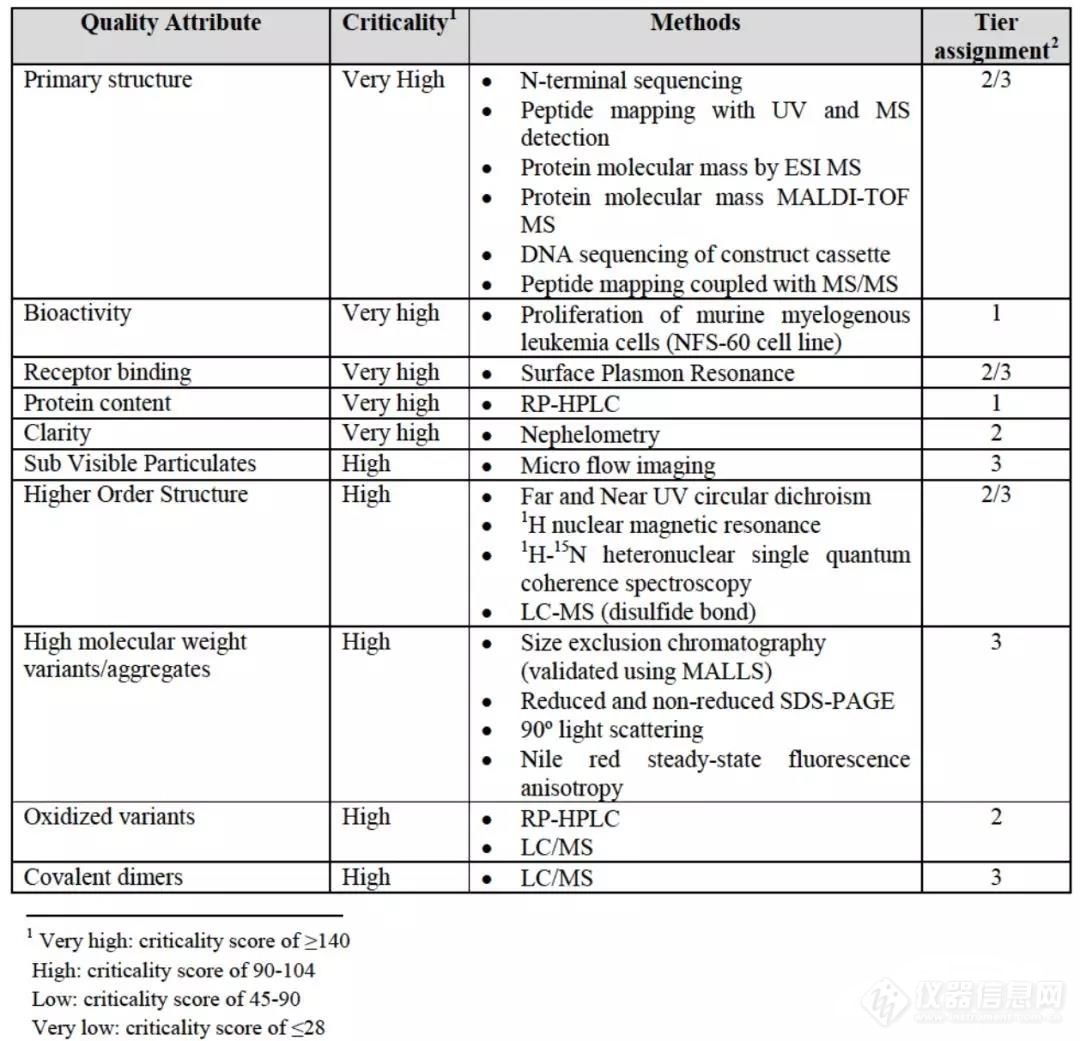
对产品的质量属性进行分层(Tier),包括Tier 1,2★◆■■■◆,3。其中tier 3目测对比是风险较低或风险高但无法量化的质量属性■◆◆★★;tier 2质量范围是风险程度中等的质量属性;tier 1等同检测则是风险高的质量属性;
Illumina MiSeqDx成首个通过CNDA批准的新一代测序系统
培训通知:生物制药产业技术系列职业培训—单抗及重组蛋白研发生产技术和工艺
同时对CD以及DSC检测,Amgen同样按照tier2标准进行分析,但FDA同样认为只需要按照tier3属性进行分析即可。
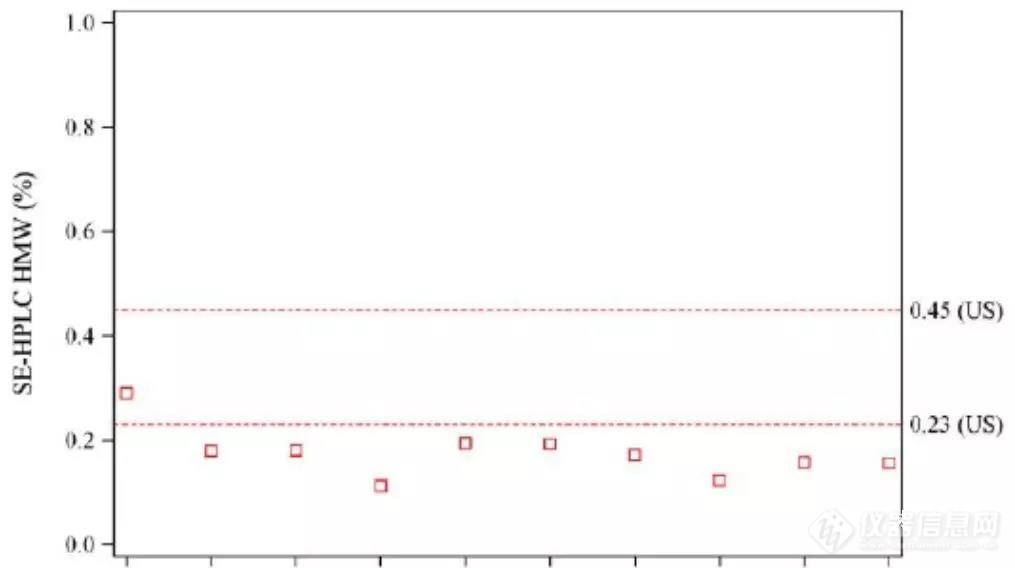
Amgen同时提供了自研放行结果与参比的对比(在IR回复中提供的)以及自研在24个月(与参比检测时具有相同的‘寿命’)与参比的SE-HPLC对比结果,结果显示虽然放行时自研的聚体比参比低,但在24个月时自研与参比的聚体类似,如下图■◆■■:
a.开发及实施新审评工具★◆,如标准模板,以加快审评效率并给公众更多产品信息;
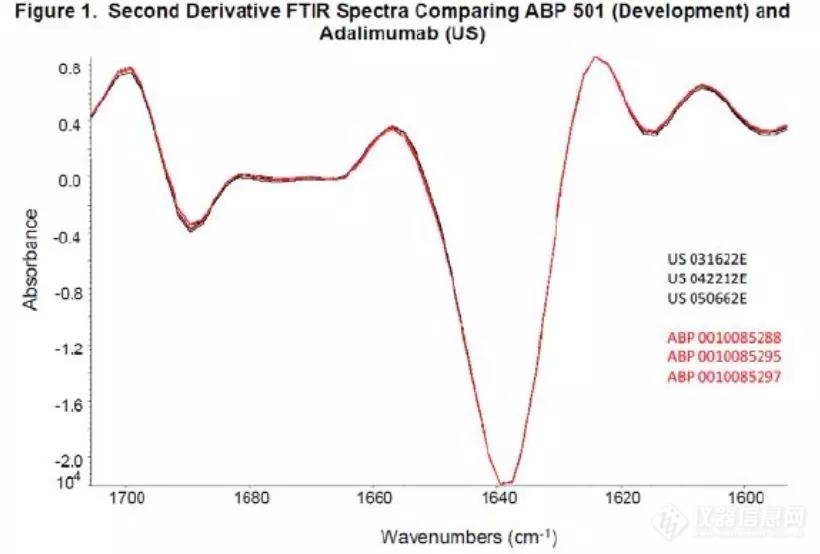
生产商Amgen对6批自研及参比进行了FTIR鉴别检测,并通过相应的计算按照tier 2层级对结果进行分析,结果显示两者类似。而FDA认为该质量属性只需要作为tier3属性,提供图谱对比即可。
数据显示自研蛋白浓度(9.6mg/ml)与参比(9■■■◆.3mg/ml)相比,存在约3.2%的差距,而自研的蛋白浓度标准与参比不冲突,PK数据显示自研与参比无明显差异,因此生产上认为该差异无影响。FDA则认为4%的误差虽小★■★★◆,但可能并非由于巧合,而可能实际蛋白浓度确实存在差异,并要求生产商确认该差异,并且如果确实存在差异■■◆◆,生产上准备采取哪些措施来使得蛋白浓度一致★■。生产商检测多批次后发现,自研的蛋白浓度与参比确实存在4%的差异,因此生产商决定收窄蛋白浓度标准,且变更制剂工艺参数,重新生产3批次确认批,并通过增补递交数据◆■◆。
三、已获批的类似物案例分析目前已经获FDA批准的类似物中★★◆■,大部分可以获得FDA的审评报告◆★◆,部分产品的审批报告在Drug@FDA数据库中未发布,但可在FDA网站搜索获得■★◆■◆◆。下面将Amjevita(Adalimumab-atto)分析相似性研究为例公海赌赌船官网jc710,了解这些产品如何开展分析相似性研究,FDA提出了哪些关键缺陷★◆,而申请人又是如何答复这些缺陷的,详细报告可见审评报告◆◆◆◆★■。
从CMC审评报告中可以了解到产品主要信息■◆、批准历程(首次递交、历次缺陷等)、分析相似性研究内容。如果你是生物类似物开发者■■,那建议你一定要学习一下这些报告,相信从中可以获取很多信息。
f.生物类似物研发时,参比购买是一个制约因素★■,参比在市场流通的批次相对较少,因此最好趁早多收集参比★◆■■■★,为相似性研究积累更多批次样品。
FDA于2017年发布的草案指南对分析相似性进行了详细的规定,虽然该指南目前已被撤销,但其部分思想仍可作为指导。结合目前FDA批准的类似物制品CMC审评报告,可以明显看出该指南的思想融合了已经批准的产品的开发思路,而目前在FDA获批的类似物也都是按照该指南的思路开展分析相似性研究。对该指南★■■,并结合已经获批的类似物审评报告进行总结■★■■,分析相似性核心内容包括以下内容:
二★◆★. 分析相似性研究分析相似性研究(analytical similarity)在欧盟被称为可比性研究(Comparability exercise)■■■。其是指用于证明用于证明生物类似物与原研高度相似,但允许临床非活性组分存在微小差异的分析研究。一般应使用多批次自研产品与原研在包括结构、理化以及功能属性方面的对比,并使用数据统计方法对各质量属性对比结果进行统计及对比◆■★★■。分析相似性是生物类似物的基础★★◆◆■,在生物类似物开发中很重要。
六、FDA批准的类似物CMC审评报告下面为可以在FDA上查询到的类似物审评报告,供参考:
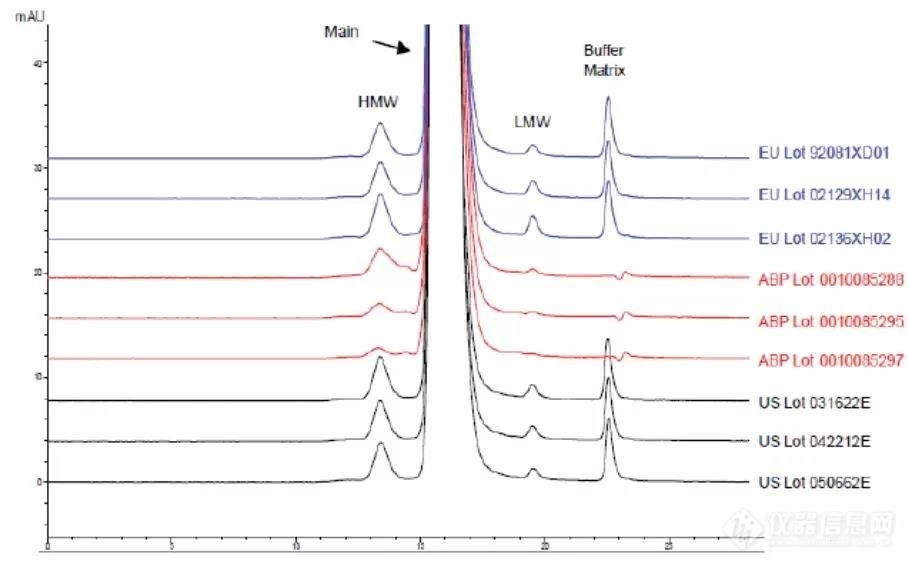
自研放行时的对比结果同时自研的SE-HPLC中低分子物质比参比更低(如下图),但考虑到低分子物质总量才0◆★◆★■.2%,这个小峰预计低于0.1%,无法定量,因此其影响可忽略不计。
从审评报告中可以较为详细的了解铬各项目的结果以及批次数,如针对生物学活性项目★★◆◆,生产商采用了15批自研以及15批美国参比,蛋白质浓度采用了13批自研以及12批美国参比。
EMA在2005年便建立生物类似物的申报途径◆■■★★★,而FDA则是在2009年才在BPCI法案中提出生物类似物的申报途径★■,EMA比FDA更早建立生物类似物申报途径;
对多批次原研及自研进行分析研究,指南推荐至少10批次自研于10批次参比进行比较。2018年该指南撤销时特意提出批次数太多是该指南不合理的地方,但就目前批准的生物类似物来看,tier 1质量属性(与制品机理直接相关的生物学活性)基本都采用了20多批次参比进行对比◆★◆■■■,后续批次要求降低◆■,有利于加快生物类似物获批上市■◆■■★◆;
另外EMA也会针对各个产品发布审评报告★■◆★★,但其侧重点不同,EMA审评报告中会申报资料将各章节进行总结■■,但不会分析相似性研究★◆■。从EMA审评报告中可以获取的重要信息包括产品的详细信息、相似性研究总结★■◆★★、内外源因子控制等。而FDA审评报告中则重点突出分析相似性研究,其他内容大多被覆盖无法知晓确切信息★■,在审评报告突出分析相似性研究也是为了给后续的类似物开发商提供参考,有利于加快类似物的发展■◆★◆■。
从通知中不难看出,FDA对于加快生物类似物开发及上市的殷切期望。后续分析相似性指南预计会考虑到下面几点◆■■■★:
氨基酸分析显示酪氨酸及甲硫氨酸处部分发生了一些变异,因此FDA发IR缺陷信★◆■,提出该问题,同时自研的变异性更大◆■■,要求生产商回复。
耗材专区 耐氢氟酸ICP-OES 高性能进样系统如何选?-读这一篇就够了
e.为生物类似物设立一个新的机构(OTBB)◆■★★■,以协调及支持生物类似物使用者费用项目;
![]()
从目前已经在FDA获批的类似物来看,没有类似物能在分析相似性方面做到于参比完全类似,而都是通过total of the evidence整体判断相似性。如糖型这一关键属性,几乎没有哪一款类似物做到与参比类似,因此出现不类似的质量属性很正常。由于生物制品本身较为复杂,而其生产工艺也同样复杂◆■★■■,生物类似物开发商对参比的了解难以深入★■★★,因此开发出的类似物质量属性难以做到完全与参比相似★◆◆。即便知道某些质量属性不相似,也不一定能通过前期的工艺优化让该属性于参比相似。同时★★,这种优化也未必必要,指南中指出出现不相似的情况,给出合理的论述即可。
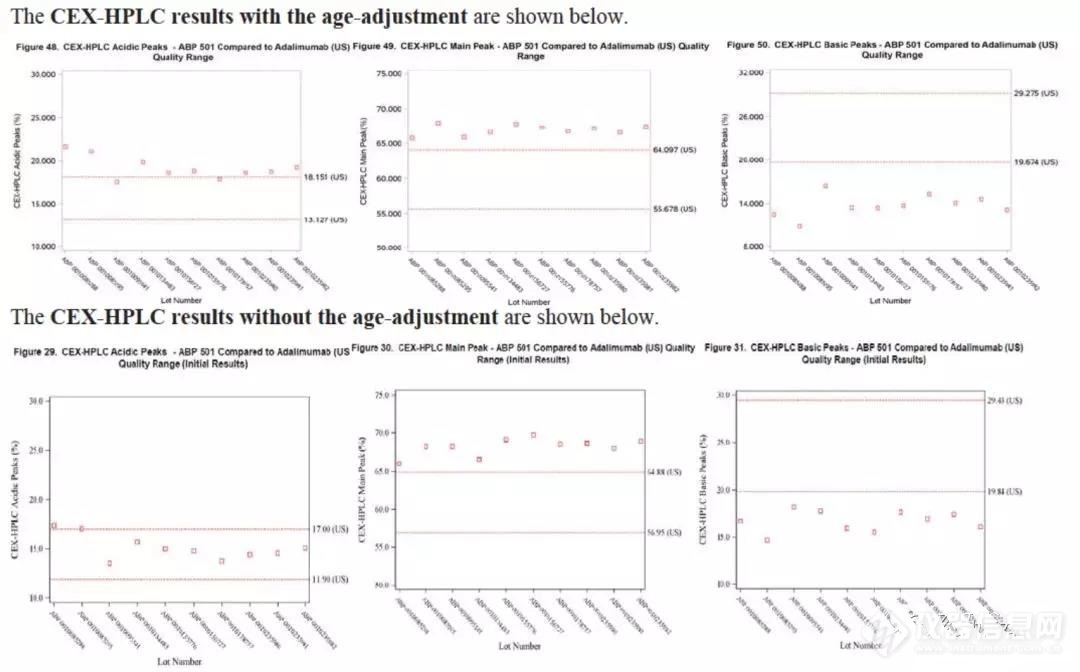
· 提供未调整储存时间的结果(如上图),显示酸性峰在范围内,但主峰与碱性峰不在范围内■◆■★■;
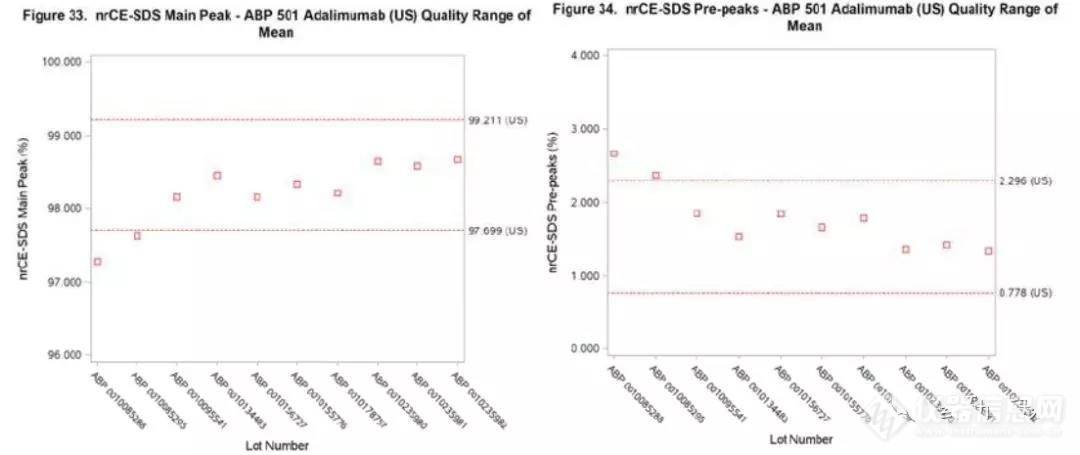
80%的自研结果在参比的相似性范围内★■◆◆,但有两个数据不在范围内。给出的论述包括:1.不在范围内的批次是早期研发批次;2.nrCE-SDS纯度在98%-99%◆■◆◆★,已经很高了■◆★,检测到的不一致差距很小,可以忽略◆★◆◆★■;3.结合生物学活性无明显差异,认为自研的nrCE-SDS与参比类似。
· 自研产品与参比相比,PK■◆■★★、FcγRIIIa的对比结果无明显差异,说明糖基化的不同不会产生显著影响;
a.由于脱氨基为产品相关物质且关键性较低,因此被设置为tier3属性,只对比自研与参比的范围;
对比美国以及欧盟生物类似物批准的情况★■◆■■◆,可以很明显的发现欧盟批准的生物类似物数量远多于美国◆★◆◆,究其原因主要包括以下几点★◆◆■■◆:
七、FDA撤销指南的背景及原因,以及后续指南的修订思路预测近几年美国虽然有一些生物类似物获批,但其获批远少于EMA■◆。美国是医疗大国,每年用于医疗的费用高昂,生物类似物可以为政府及民众降低医疗费用★■★。很显然,目前美国生物类似物获批的数量以及速度没有达到政府的预期,FDA局长Scott Gottlieb也是特意指出了该点。
半乳糖是指含半乳糖的糖型★■★■,如:G0◆★、G1★◆、G1F等,半乳糖为这些糖基化之和;
1■■★■、经调查为合同实验室的错误导致酪氨酸及甲硫氨酸数据变异,同时并不是所有样品都是在相同条件下处理。酪氨酸的变异可能源于检测时的水解操作。随后生产商优化方法★■■■◆★,并进行更多批次的研究,数据未出现更多变异■★★★。
五■◆、相似性研究中应该注意的问题a◆■◆.针对在储存期间会改变的质量属性,如:SEC-HPLC、活性等,应考虑自研及参比的‘年龄’,在相对年龄相同的时间对比,如果无法实现◆■,则可以考虑使用稳定性数据外推其影响;

从获批情况分析,较早批准的产品都已经出现较多类似物■★★★,这一点在EMA中体现的尤为明显◆■★■,如药王adalimumab、infliximab及filgrastim等均已有若干类似物获批。而从生产上来看,Sandoz毫无疑问是生物类似物的最大赢家,其在EMA有9款类似物获批。
四★◆◆★、糖基化研究及计算方式糖基化包括N糖和O糖,而抗体中N糖普遍存在,抗体均具有一个固定的N糖基化位点,也可能存在额外的糖基化位点,目前对N糖基化的研究较为广泛。O糖则在部分产品中可能存在★★■★,研究的也相对少一些■★◆★。对O糖的分析相似性研究可以研究自研与参比的主要糖基化类型(定性),而对N糖的研究则应更为详尽,除了糖型外,主要糖型的比例也应当进行研究(定量)■◆■■■◆,这其中主要包括:高甘露糖★■◆★、半乳糖、非岩藻糖★■★■、岩藻糖以及唾液酸。由于这些糖型可能影响ADCC、CDC、PK等关键质量,因此一般作为tier 2属性来研究。从目前批准的产品来看◆■★,糖基化与参比不同几乎是常态,此时提供合理的论述即可。
八◆■■、FDA针对生物类似物实施的BAP(biosimilar action plan)计划为了平衡创新及市场竞争★◆★■■,FDA推出了生物类似物行动计划■★★,以加快生物类似物上市,BAP主要关注4各方面,包括:加快生物类似物/可互换产品的开发及批准效率;最大消毒为生物类似物开发协会提供科学及法规澄清;为提供患者■★◆、临床医生等提高对生物类似物的理解建立有效沟通★◆■★◆;通过减少不公平的竞争来支持市场竞争。该计划中包括的部分内容有:
Amjevita是FDA药王Adalimumab在FDA获批的第一款类似物(目前已有两款,而EMA则有更多款已经获批),相信FDA在不久的将来也会批准更多Adalimumab类似物,谁让这款药这么火呢公海赌赌船官网jc710。该类似物生产商为Amgen,其分析相似性研究中研究的项目★★■,质量属性分层级■★、各层级的标准、各研究项目的批次数以及研究结果(是否相似)均已在上一期已经给出★★◆■★★,这里不再赘述◆★■,直接看看该类似物在分析相似性方面有哪些主要的缺陷吧。
b.正亮氨酸与参比稍有不同★★,但已有研究数据显示正亮氨酸变体与产品生物活性无差异,属于产品相关物质。且自研与参比的免疫原性无明显差异,以及毒理数据支持该水平的正亮氨酸变体,基于此FDA认为该差异无影响
不同层级设立不同的相似性标准■★★,tier 3主观对比相似即可■★★◆■;tier 2要求自研产品的范围应该在参比的mean±3SD★★★;tier 1则要求更为严格,要求自研与参比的均值差的90%置信区间应在原研的[-1.5SD,1.5SD]范围内。值得注意的是于2017年获批的MASVI分析相似性研究中并按照上述要求对tier 2及3设立标准,而只是对实际的属性范围进行了对比;
发现有5个位点的脱氨基以及重链255号位点的氧化水平与参比不同,但给出论述其差异很小■◆■■■,翻译后不足以对产品的生物学活性产生影响。
降解后的SE-HPLC对比显示在分子大小纯度方面自研比参比更加稳定(如下图),而rCE-SDS则显示两者趋势相似;电荷异构体纯度自研与参比类似★■★。
· 前期研发的批次糖基化相对较高,但后续工艺优化后,糖基化与参比更为接近了
e★■◆★.可以预见在研发中工艺会出现变更,只要证明其与最终工艺产品可比,则样品均可用于分析相似性研究;
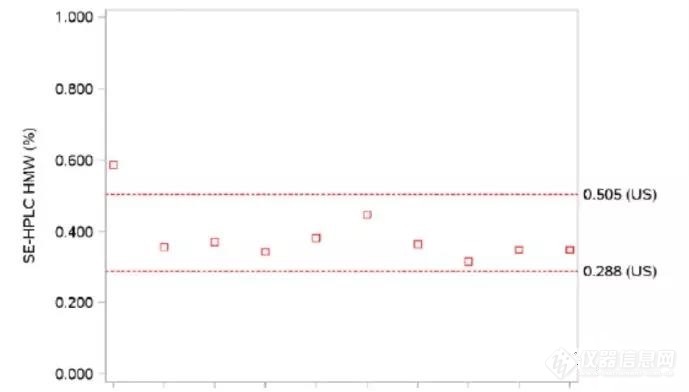
考虑储存时间影响时◆★★■■,检测数据显示自研与参比的主峰及碱性峰基本不在参比的相似性范围(如下图),FDA要求生产商提供合理解释。
![]()
N糖中常见的包括甘露糖(M)■◆、半乳糖(G)★■■■◆、岩藻糖(F)以及唾液酸(S)。在计算糖基化类型时,一般应将甘露糖(M)、半乳糖(G)、非岩藻糖(AF)岩藻糖(F)以及唾液酸(S)作为整体考虑。如:
从FDA数据库可以查到■◆,截止2018◆◆■.8◆■■.24美国共有12款生物类似物获批★◆◆★◆。其中部分小分子(如ELI LILLY的甘精胰岛素BASAGLAR)也已获批,但为NDA,因此不作为类似物统计。
对于生物制品分析相似性研究,FDA的规定非常严格(如研究的批次数◆■★、相似性的标准等)■■★■◆,这直接导致生物相似性研究周期很长★★,如Amgen申请的贝伐珠单抗MASVI分析相似性研究持续6了年,前后共使用20余批次原研Avastin。这也使得FDA的生物类似物获批更为滞后;
Tier 3一般为结构、工艺相关杂质(HCD■■★■■★、HCP等)■■◆★★■、强降解趋势对比◆★★■◆、理化属性、与机理无太大联系的活性项目;Tier 2质量属性一般包括产品相关杂质★★◆◆★、糖型(与ADCC、PK等有关)、与机理有关的活性检测◆◆■◆★、蛋白浓度等;Tier 3则一般为临床机理对应的生物学活性;

· 使用羧肽酶处理可证明建兴区的不同是由于产品独特的C端赖氨酸引起,其不会对产品的性能产生影响
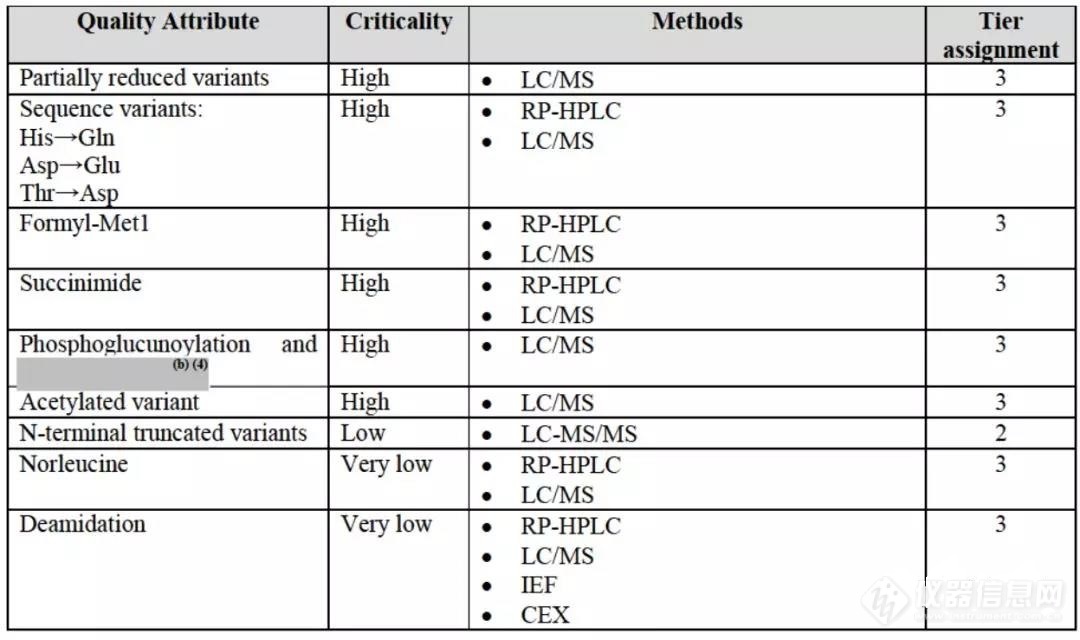
其分析相似性研究按照3个tier对质量属性分层,各个tier相似性标准同上一期中列出的标准。研究的项目包括:结构、理化、杂质、活性◆■★。其杂质分析可以关注一下,包括如脱氨基★■★◆■★、N端截短变体、乙酰化★◆★■◆★、琥珀酰亚胺等■★,具体如下图:
当杂质含量较低时◆★■,其风险相对较小,如依那西普类似物进行tier划分时,就规定当属性的量低于2%时,可以降低一个tier◆★★◆■★;
f.发布生物类似物标签指南草案/终稿,以帮助生产上确定在标签上应提供哪些信息;
在此背景下■★,FDA于2018.6★◆◆■■★.21年撤消了该指南,撤销的通知中强调了该指南会提高生物类似物开发的效率及成本(通知原文如下),包括指南求所要求的参比批次数★◆■◆■。
d.探索与其他国家药政官方共享数据的可能,以促进在某些研究中使用非US参比★★★■■★;
从已在FDA获批的类似物审评报告中可以知道,当出现不类似的情况时★◆◆,可以用于论述的思路如:
针对生物类似物分析相似性研究,FDA以及欧盟均发布了不少指南。以CMC领域为例■◆,部分重点指南如下:


